
مهندسی نساجی گیلان:. گیل تکس
سایت تخصصی نساجی و پوشاک
مهندسی نساجی گیلان:. گیل تکس
سایت تخصصی نساجی و پوشاکدرباره من
روزانهها
همهدستهها
- بازار نساجی 369
- اخبار نساجی 810
- سایت های نساجی 7
- مکانیک سیالات 21
- تکنولوژی نساجی 63
- مقالات نساجی 361
- رنگ و رنگرزی 48
- فناوری نانو 122
- علوم الیاف 38
- دانلود نرم افزار 14
- تکنیک و تجزیه فنی بافت 5
- نساجی و نساجان 72
- رنگرزی مصنوعی 7
- الیاف مصنوعی 27
- english 3
- نساجی جهان 30
- دنیای الیاف 15
- تصفیه پساب 12
- لباس و پوشاک 149
- کارشناسی ارشد و دکترا 11
- دانلود کتاب 57
- مد و لباس 89
- نساجی سنتی 41
- عملیات تکمیل 6
- مدیریت نساجی 26
- چاپ 10
- اقتصاد 305
- دانشگاه 44
- فیزیک الیاف 7
- شیمی عمومی 3
- شیمی پلیمر 6
- کامپوزیت با الیاف 6
- فروشگاه نساجی گیل تکس 19
- آگهی استخدام 200
- نمایشگاه و همایش های نساجی 71
- فیلم 35
- گفتگو 89
- فرش و کفپوش 9
ابر برجسب
پوشاک آگهی استخدام نساجی وزارت صنعت، معدن و تجارت نساجی قائمشهر بیکاری رزومه چین نساجی بروجرد انجمن صنایع نساجی ایران مهندس نساج خانم پلی اکریل ایران بحران اقتصادی فرش ماشینی کارگران پلی اکریل زنجان فرش برند ایرانی علیرضا حائری قائم شهر یزد ترکیه پتروشیمی بورس چادر مشکی مهندس نساج کارخانه نساجی ارز نانوالیاف کارگر نساجی الیاف برند پوشاک لرستان نفت نساجی حجاب وزیر صنعت، معدن و تجارت تورم دانشگاه صنعتی امیر کبیر نمایشگاه بینالمللی صنعت نساجی گمرک تحریم صادرات مد فناوری نانو پلی اکریل پارچه برند مهندس شیمی نساجی پنبه رکود انجمن صنایع نساجی لباس نساجی مازندران واردات قاچاق مهندس نساجی اصفهان استخدام نساجی ورشکستگی آگهی استخدام مهندس نساجیبرگهها
- گرماسنجی (کالری متری)
- کروماتوگرافی
- آزمایش خستگی
- عنوان آزمایش :تعریف متغیر، توابع ریاضی و رسم نمودار در MATLAB .
- مرسریزاسیون
- هیدرولیز قلیایی پلی استر
- دانلود کتاب نساجی
- دانلود مقالات علمی
- تکنولوژی تولید الیاف
- فیزیک الیاف
- تکسچرایزینگ
- رنگرزی مصنوعی
- استحکام نخ
- اندازه گیری نمره نخ
- ضایعات پنبه
- اندازه گیری تجعد نخ
- اندازه گیری رطوبت بازیافتی
- رسیدگی الیاف پنبه
- تکمیل کالای نساجی
- روشهای ارزیابی مرسریزاسیون
- سفیدگری با آب اکسیژنه
- مرسریزاسیون
- صمغ گیری ابریشم
- کارخانه های نساجی
- آز شیمی عمومی
- کنترل کیفیت
- تعیین ضخامت
- الیاف مصنوعی
- لیف پلی استر
- نایلون6
- نایلون66
- پلی پروپیلن
- پلی اتیلن
- شیشه
- کتان
- کنف
- رامی
- سیسال
- الیاف طبیعی
- پرطرفدارترین برندهای دوربین
- اصول شیمی پلیمر
- اکسترودر
- تعیین وزن مولکولی پلی استایرن به کمک ویسکومتری
- تهیه پلی استایرن
- تهیه ی رزول و نوولاک
- نایلون۶/۶
- مقالات رنگرزی،چاپ و تکمیل
- ساماندهی
- صفحه آزمایشی
- Remarkable strength in NY cotton market
- A good news for Life& Style!!!
- آبهای صنعتی Industrial Waters
- دانلود سوالات ارشد شیمی نساجی و علوم الیاف
- دانلود سوالات ارشد تکنولوژی نساجی
- دانلود سوالات ارشد مدیریت نساجی
- حلاجی
- کاردینگ
- شانه زنی
- چندلاکنی
- فلایر
- رینگ
- نظرسنجی
- چاپ
- چاپ پارچه پلی استری با رنگینه دیسپرس
- همه چیز درباره ی پلی استر
- تهیه اسید نیتریک
- همه چیز درباره ی پنبه
- همه چیز درباره ی پنبه2
- همه چیز درباره ی پنبه3
- همه چیز درباره ی پنبه4
- استخدام
- مقدمه -پیل سوختی-1
- انواع -پیل سوختی-2
- نانوالیاف-پیل سوختی-3
- انواع غشاهای مبادله گر یونی-پیل سوختی-4
- پلی کتون های سولفونه-پیل سوختی-5
- غشاهای مرکب تقویت شده -پیل سوختی-6
- الکتروریسی-پیل سوختی-7
- الکتروریسی پلیمرهای رسانای پروتون-پیل سوختی-8
- الکتروریسی PFSA-پیل سوختی-9
- اشباع حصیر الیاف-پیل سوختی-10
- هدایت پروتون در بخار آب-پیل سوختی-11
- استفاده از نانوالیاف کربن در پیل های سوختی-12
- استفاده از نانوالیاف پلی وینیل الکل به عنوان تقویت کننده-13
- شناسایی الیاف به روش میکروسکوپی(سطح مقطع طولی)
- تست حلالیت _ تاٽیر حلالهای شیمیایی بر الیاف طبیعی
- تست حلالیت _ تاٽیر حلالهای شیمیایی برالیاف مصنوعی
- ادامه تست حلالیت _ تاٽیر حلالهای شیمیایی برالیاف م
- شناسایی لیف مجهول
- آزمایش comb sorter
- گزارش کار آزمایشگاه شیمی عمومی-تعیین سرعت واکنش
- عنوان آزمایش: اندازه گیری مقدار Cl- در محلول
- محاسبه غلظت H3PO4
- عنوان آزمایش: اندازه گیری غلظت بی کربنات سدیم
- استاندارد کردن پرمنگنات با استفاده از اگزالیک اسید
- انواع تیتراسیون های کمپلکسو متری ( مستقیم ، برگشتی
- آزمایشگاه شیمی تجزیه
- تجزیه پارچه1
- تجزیه پارچه2
- تجزیه پارچه3
- تونل باد
- تعیین آزمایشی تلفات در لوله های با قطر کوچک
- کشش سطحی
- مــرکــز فشــار
- وسایل اندازه گیری شدت جریان
- Download Free Textile Dictionary For Mobile
- blank
- تبلیغات
- دانلود رایگان کتاب شیوه های جدید قلاب بافی
- کتابخانه مجازی نساجی
- نظرسنجی
- درباره ما
- نظر سنجی
- کاردینگ C50
- اصول تصفیه پساب صنایع نساجی
- مطالب جدید
- مطالعه پایدارسازی الیاف کربن به وسیله آنالیز حرارتی موضعی (مکانی
- صفحه میانبر
- فروشگاه
- بررسی شرایط استخراج رنگزااز ریشه گیاه روناس
- اثر آنزیم لاکاز روی کالای پنبه ای رنگزی شده با رنگدانه
- سنگ شویی جین با استفاده از پرلیت و مقایسه آن با پوکه معدنی
- اثر عملیات بعدی بر کالای سنگشویی شده با پوکه و سلولاز
- تاثیر عملیات مرسرایزینگ بر خصوصیات ابعادی پارچه حلقوی پودی ساده
- اندازه گیری لحظه ای غلظت رنگزا در حمام رنگرزی
- دیکشنری آنلاین نساجی- لغتنامه انگلیسی به فارسی نساجی- ص 1
- دیکشنری آنلاین نساجی- لغتنامه انگلیسی به فارسی نساجی- ص 2
- دیکشنری آنلاین نساجی - ص 3
- دیکشنری نساجی ص 4
- دیکشنرینساجی ص 5
- دیکشنری نساجی ص 5
- دیکشنری نساجی ص 6
- دیکشنری نساجی ص 7
- معرفی محصولات نانویی ساخت ایران
- معرفی محصولات فناوری نانو در صنعت نساجی
- متن کامل مجله نساجی کهن شماره 38
- ماهنامه دنیای نساجی (شماره ۱۷)
- بررسی قالی چله پشم
- راهنمای خرید نوشت افزار
- تور استانبول
- وظایف ادمین پیج چیست؟!
- تعمیر کولر گازی در آمل، بابل، بابلسر و محمودآباد با خدمات حرفهای و سیار «تعمیرات زمانی»
جدیدترین یادداشتها
همه- سیستم «هویت مواد» برای پارچهها — انقلابی در بازیافت و زنجیره تأمین
- میزان دستمزد سال1402بافنده
- آگهی استخدام مهندس نساجی با گرایش شیمی و علوم الیاف در یک شرکت بازرگانی در تهران
- آگهی استخدام کارشناس آزمایشگاه با مدرک کارشناس شیمی نساجی درمحدود احمداباد مستوفی
- آگهی استخدام مهندس تکنولوژی نساجی در تهران 7 شهریور 1401
- آگهی استخدام مدیر تولید با مدرک مهندسی صنایع نساجی در شهرقدس
- استخدام مهندس نساجی در یک شرکت بازرگانی در تهران ۱۴۰۱/۰۶/۰۶
- خرید تخت بیمارستانی 3 شکن
- طراحی وبسایت به سبک Aviation
- باکس گل shadichi
- استخدام مدیر کنترل کیفی در یک شرکت معتبر نساجی در اصفهان
- تعویض تاج تسمه راپیر ماشین های بافندگی
- مراحل تبدیل بطری پلاستیکی نوشیدنی به پوشاک
- جمع خوشتیپها کامل شد
- محبوب ترین جاذبه ها و تفریحات نزد مسافران
- سفر به کیش مروارید خلیج فارس
- مرکز خدمات و پشتیبانی ماشین های اداری اپسون
- ایده شو اولین دورهمی ایدههای برتر صنعت نساجی
- سؤال از وزرای اقتصاد و صنعت درمورد کارخانه های نساجی مازندران
- تاخیر بسیار زیاد ترخیص کالا مانع رشد صنعت است
- ۹۸ درصد صنعت نساجی ایران در دست بخش خصوصی
- ارائه تسهیلات نوسازی به صنعتگران بخش نساجی زنجان
- موشن گرافیک "صنعت پوشاک در ایران"
- علی وحدت دکتری نساجی ، رئیس صندوق نوآوری و شکوفایی شد
- مشکل واحدهای تولیدی پوشاک همدان ،تأمین سرمایه درگردش است
بایگانی
- آذر 1404 1
- فروردین 1402 1
- شهریور 1401 5
- خرداد 1400 1
- اردیبهشت 1398 3
- اسفند 1397 1
- بهمن 1397 3
- دی 1397 2
- آذر 1397 2
- آبان 1397 3
- مهر 1397 77
- شهریور 1397 8
- مرداد 1397 3
- خرداد 1397 24
- اردیبهشت 1397 11
- اسفند 1396 19
- بهمن 1396 25
- دی 1396 15
- آذر 1396 12
- آبان 1396 45
- مهر 1396 9
- شهریور 1396 12
- مرداد 1396 25
- تیر 1396 11
- خرداد 1396 5
- فروردین 1396 1
- اسفند 1395 12
- بهمن 1395 83
- دی 1395 2
- آذر 1395 14
- آبان 1395 42
- مهر 1395 34
- شهریور 1395 48
- مرداد 1395 81
- تیر 1395 38
- خرداد 1395 4
- اردیبهشت 1395 11
- فروردین 1395 43
- اسفند 1394 1
- دی 1394 59
- آذر 1394 84
- آبان 1394 35
- مهر 1394 35
- شهریور 1394 32
- مرداد 1394 16
- تیر 1394 5
- خرداد 1394 34
- اردیبهشت 1394 1
- اسفند 1393 17
- بهمن 1393 2
- دی 1393 1
- آبان 1393 4
- شهریور 1393 23
- مرداد 1393 7
- تیر 1393 29
- خرداد 1393 3
- اردیبهشت 1393 5
- فروردین 1393 2
- اسفند 1392 29
- بهمن 1392 37
- دی 1392 21
- آذر 1392 60
- آبان 1392 49
- مهر 1392 48
- شهریور 1392 59
- مرداد 1392 47
- تیر 1392 34
- خرداد 1392 8
- اردیبهشت 1392 303
- فروردین 1392 30
- اسفند 1391 17
- بهمن 1391 14
- دی 1391 14
- آذر 1391 15
- آبان 1391 31
- مهر 1391 5
- شهریور 1391 24
- مرداد 1391 13
- تیر 1391 13
- خرداد 1391 27
- اردیبهشت 1391 32
- فروردین 1391 11
- اسفند 1390 31
- بهمن 1390 85
- دی 1390 47
- آذر 1390 16
- آبان 1390 44
- مهر 1390 27
- شهریور 1390 7
- مرداد 1390 11
- تیر 1390 15
- خرداد 1390 69
- اردیبهشت 1390 16
- فروردین 1390 45
- اسفند 1389 51
- بهمن 1389 15
- دی 1389 135
- آذر 1389 44
تقویم
آذر 1404| ش | ی | د | س | چ | پ | ج |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| 29 | 30 |
جستجو
گزارش کار آزمایشگاه شیمی عمومی-تعیین سرعت واکنش
هدف آزمایش: اثر غلظت برسرعت واکنش
وسایل مورد نیاز:
ارلن ، پی پت ،
پی ست ، کرنومتر ، پی ست
مواد مورد
نیاز:
محلول پتاسیم یدات0.02M ، محلول سولفیت سدیم
تئوری:
سینتیک شیمیایی:
سینتیک شیمیایی یا سینتیک واکنش شاخهای
از علم است که به مطالعهی سرعت فرآیندهای شیمیایی و عوامل موثر بر آنها
میپردازد.
سرعت واکنش :
عبارت از تغییر غلظت هر یک از مواد اولیه یا مواد
حاصل نسبت به زمان انجام واکنش است
1- اندازه گیری سرعت واکنش بین ید و
استون:
2- بررسی بعضی از عوامل مؤثر بر سرعت واکنشهای شیمیایی: مانند غلظت
و کاتالیزور
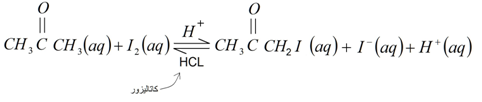
سرعت واکنش؟
کمیتی مثبت است که میزان
تغییر غلظت یکی از واکنش دهنده ها یا محصول واکنش را نسبت به واحد زمان (ثانیه،
دقیقه، ساعت و ... ) نشان می دهد.
عوامل مؤثر بر سرعت واکنش:
1- نوع واکنش
دهنده
2- غلظت واکنش دهنده ( با افزایش غلظت، سرعت افزایش می یابد )
3- دما
(افزایش دما باعث افزایش سرعت می شود ،گاهی با افزایش 10 درجه، سرعت 2 تا 3
برابر می شود ) دما روی k تاثیر دارد ، روی سرعت هم تاثیر می گذارد.
K= ثابت سرعت ؛ A= فاکتور فرکانس؛ = انرژی فعالسازی
R= ثابت
جهانی گازها؛ T= دما ( کلوین )
4-کاتالیزور ( در وجود کاتالیزور واکنش با سرعت
بیشتری انجام می گیرد )
مثالهایی از واکنش های فوق سریع :
تشکیل رسوب نقره
کلرید به هنگام مخلوط شدن محلولهای حاوی یون های کلرید و نقره
تشکیل آب به محض
مخلوط شدن محلول های اسید و باز در معادله ی شماره ی(2) و
نشانه ی غلظت مولی واکنش دهنده های A و B است.
K ثابت سرعت واکنش (rate
constant ) نامیده می شود.
m و n مرتبه ی واکنش نسبت به واکنش دهنده های A
و B است.
می توان سرعت واکنش را با تغییر دادن غلظت موارد اولیه تغییر
داد.
برای مثال اگر غلظت اولیه ی استون را نسبت به مخلوط شماره ی (I) دو برابر
کنیم، اما غلظت ید و را ثابت نگهداریم، معادله ی سرعت برای مخلوط شماره
ی (II) تغییر خواهد کرد. معادله ی (7ب ) معادله ی سرعت را برای مخلوط شماره ی (II)
نشان می دهد :
تاثیر سرعت روی غلظت با استفاده از روابط
ریاضی:
از تقسیم دو رابطه ی (7) بر
یکدیگر می توان m ( مرتبه ی واکنش نسبت به استون ) را بدست آورد :
با اندازه
گیری سرعت واکنش در مخلوط های (I) و (II) می توان نسبت سرعت ها را که
مساوی است پیدا کنیم. سپس معادله را برای محاسبه ی m از طریق
لگاریتم حل می کنیم. اگر نسبت عددی را برابر Y فرض کنیم، جواب آن بدین
شکل است
:
به روش مشابه نیز می توانیم مرتبه ی واکنش را نسبت به غلظت یون
و تعیین کنیم. سپس با داشتن مرتبه ی هر واکنش دهنده، غلظت آنها و سرعت
واکنش و K را بدست آوریم.
روش کار :
ابتدا
درهرمرحله مقدارپتاسیم یدات وآب مقطر رادرارلن بریزید،سپس بااضافه کردن مقدار
سولفیت سدیم(نشاسته)کرنومترراآغاز وباکدر شدن محلول(نشانه پایان
واکنش)کرنومتررامتوقف وزمان رایادداشت کنید.این کاررابرای مراحل با غتظت های متفاوت
پتاسیم یدات انجام دهید ونتایج رایادداشت کنید.
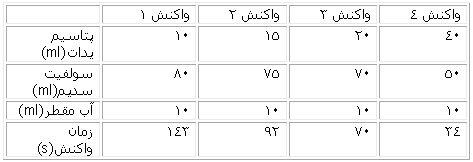
جدول حاصل از آزمایش:
جدول حاصل از محاسبات:
lnCA/CA. CA/CA. K
(1/s)
R
(mol/m3.s) t
(
s) CA.=.[KIO3]
(mol/Lit) CA=[KIO3]
(mol/Lit)
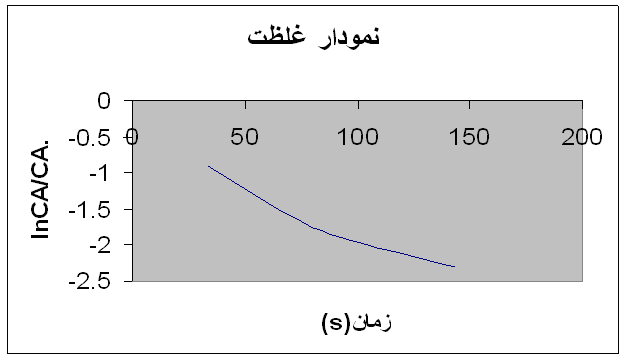
2.3- 0.1 0.016 0.013 143 0.02 0.002
1.89- 0.15 0.02 0.032 92 0.02 0.003
1.6- 0.2 0.022 0.057 70 0.02 0.004
0.91- 0.4 0.026 0.235 34 0.02 0.008
نمودار :
منابع و مآخذ:
http://iranchem.blogfa.com/post-136.aspx
http://chemistry-dept.talif.sch.ir/
http://edu.tebyan.net/ http://daneshnameh.roshd.ir/
www.iran.eng.com


























